- 本剤の標的であるNectin-4が皮膚に発現していることから、本剤の薬理作用に起因して皮膚反応が発現する可能性が示唆されています。
- 急速な発疹の拡大、水疱やびらんの発現、症状の遷延化を認めた場合には、早急に皮膚科専門医に相談してください。
- 重症例では皮膚粘膜眼症候群(Stevens-Johnson 症候群;SJS)又は中毒性表皮壊死融解症(Toxic Epidermal Necrolysis;TEN)に類似する臨床像を呈するが、真のSJS/TENとは発症メカニズムが異なるとの報告があります。SJS/TENの診断基準を用いて診断を行い、表⽪剥離のみをもってSJS/TENと診断することは控えてください。
- 国内外の臨床試験及び海外製造販売後において、頻度不明ながらSJS及びTEN等の重症皮膚副作用による死亡例が報告されており、臨床症状の十分な観察をお願いします。
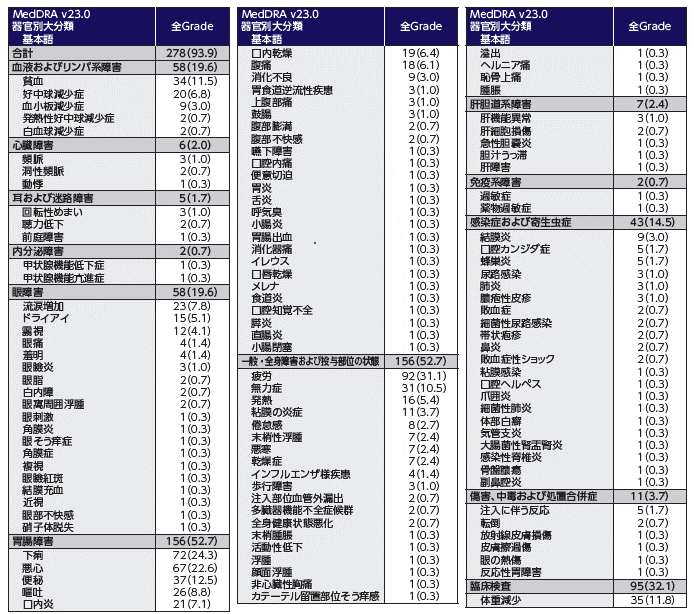
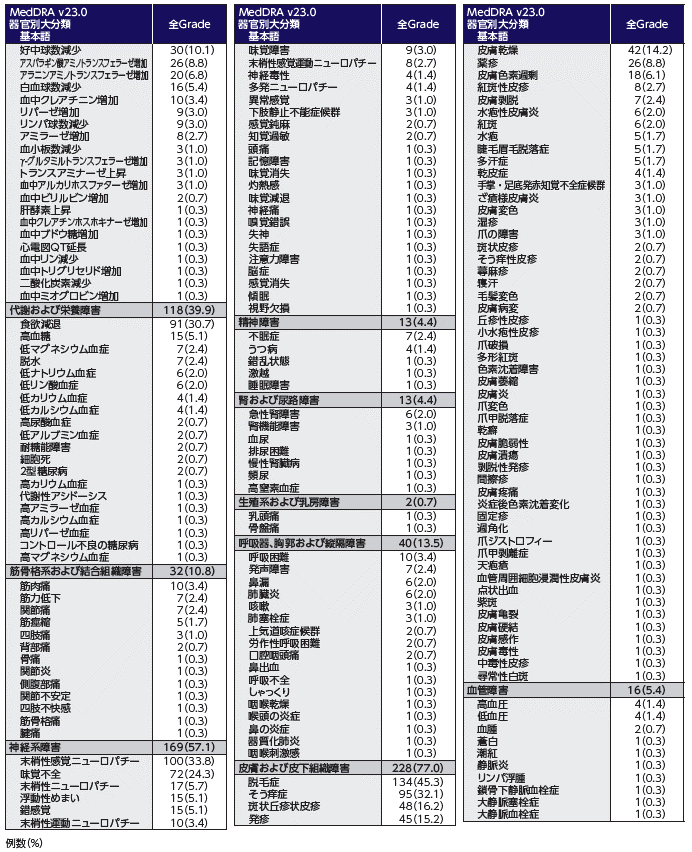
- 本剤を用いた国際共同第Ⅲ相試験において皮膚反応が高頻度に認められており、EV-301試験(エンホルツマブ ベドチン群)における発現頻度は47.0%、EV-302試験(エンホルツマブ ベドチン+ペムブロリズマブ群)では66.8%でした。皮膚反応は、特に投与開始最初の1サイクルに発現し、発現時期中央値はそれぞれ0.46カ月及び0.49カ月でした。
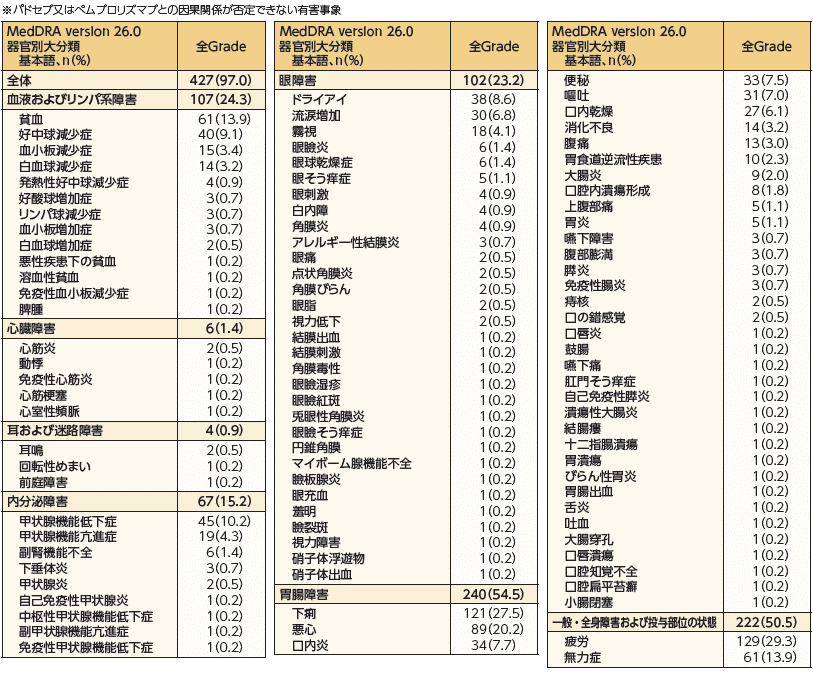
- 本剤とペムブロリズマブとの併用においては、本剤単独投与時と比較して皮膚反応の副作用発現頻度が増加することがあるため、本剤投与中は患者の状態を十分に観察してください。
- 初期症状の早期発見のために、看護師、薬剤師及び患者家族の協力が得られるよう指導してください。
- 皮膚反応の程度に応じて、休薬、減量又は中止、薬物治療(副腎皮質ホルモン剤、抗ヒスタミン剤の使用等)による適切な処置を行ってください。
詳細は副作用マネジメントガイド p.10をご参照下さい。